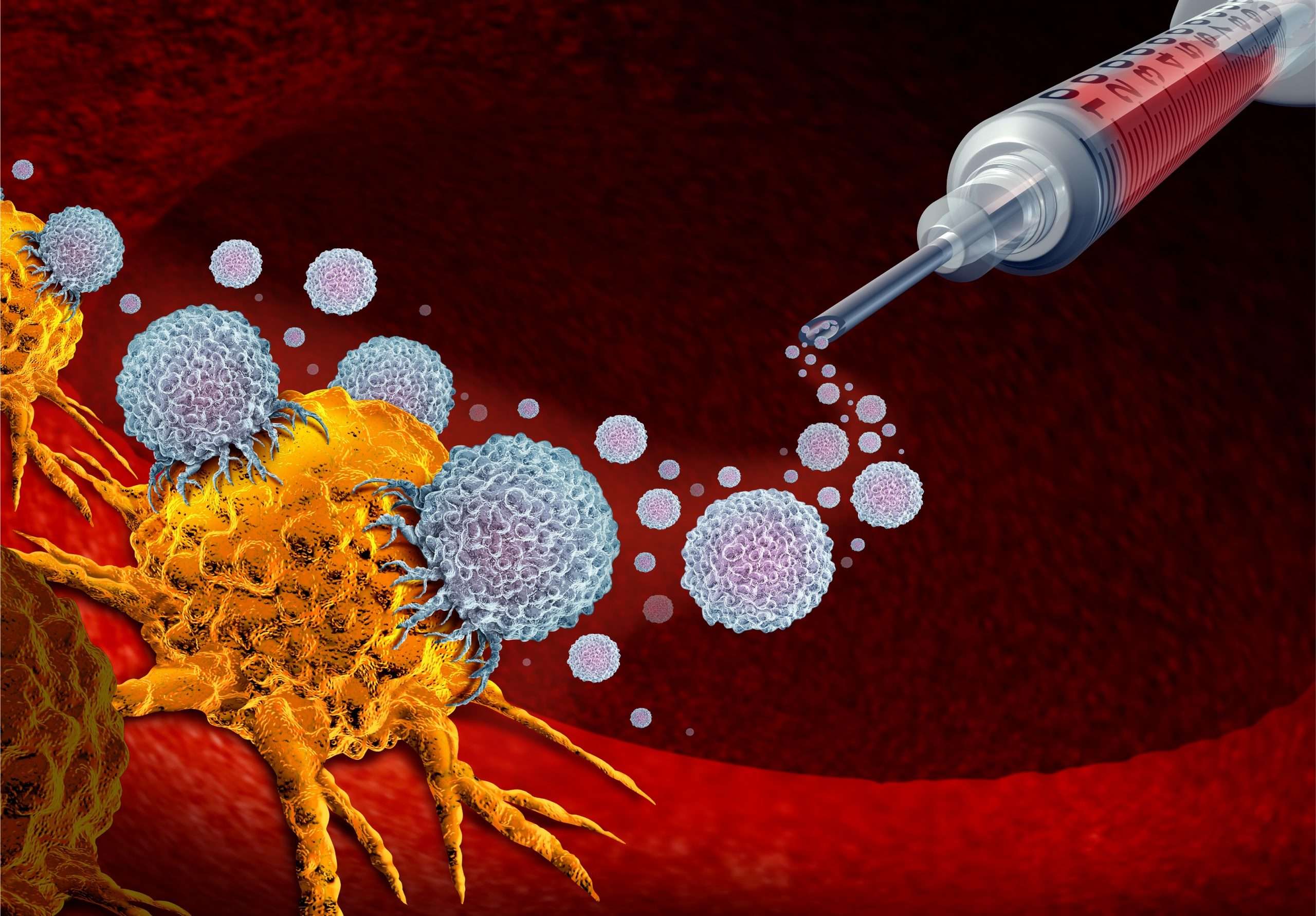
Den 25. marts ansøgte virksomheden bag CAR-T-cellebehandlingen cilta-cel, Johnson & Johnson, om, at Medicinrådet skal revurdere sin afvisning af denne behandling. I sidste uge kom svaret fra Medicinrådet endelig: Man har vedtaget at genoptage sagen. Dansk Myelomatose Forening ser meget positivt på denne beslutning, og håber, at det denne gang fører til en anbefaling af CAR-T-celler som standardbehandling af knoglemarvskræft.
Selv hos meget hårdt behandlede patienter i sene behandlingslinjer har denne CAR-T-behandling vist overordentligt gode resultater. Mange af patienterne kommer i komplet remission, altså at der ikke er nogen målbar kræft. I de tidlige forsøgsprotokoller er dette tal så højt som over 80 procent af de behandlede, og for hele 97,9 procent viste behandlingen stor effekt på kræften. Det er hidtil uhørt gode resultater for denne alvorlige sygdom.
En del danske patienter har allerede, med gode resultater, fået denne effektive behandling i første linje. Det har været i forsøg, som nu er lukkede for tilgang af flere patienter.
Internationalt rykker både EMA (European Medicines Agency) og det tilsvarende amerikanske FDA derfor nu godkendelsen helt frem til anden behandlingslinje. Desværre er det kun til fjerde behandlingslinje eller senere linjer, at det danske Medicinråd nu går i gang med at revurdere CAR-T-behandlingen.
Hvad betyder dette?
Hvis Medicinrådet ender med at godkende cilta-cel, vil det betyde, at patienter, der allerede har fået tre forudgående behandlinger, kan behandles med CAR-T-celler i Danmark, og dermed kan forvente en væsentligt længere overlevelse.
Da cilta-cel CAR-T cellebehandlingen er en engangsbehandling, betyder det også, at patienterne kan forvente lange behandlingsfrie perioder og derfor væsentligt forbedret livskvalitet.
En afvisning vil til gengæld medføre en fortsættelse af den ulykkelige situation, der gælder lige nu, hvor patienter, der ønsker CAR-T-celler, må se om de kan klare at betale for behandlingen i udlandet, og har overskud til det.
Konsekvensen af en afvisning vil være en nedbrydning af det danske solidariske sundhedssystem og stigende ulighed i sundhed, og at fanden tager de sidste, for nu at sige det som det er
Sekundær kræft ved CAR-T celleterapi
Sekundær kræft ved de “gamle” behandlinger
De fleste behandlinger mod kræft rummer en risiko for, at der udvikles en sekundær kræft. Det gælder også for myelomatosebehandlingerne. De eksisterende behandlinger, som har været i brug i en del år nu, er ingen undtagelse.
Den mest udbredte af de “gamle” behandlinger til patienter, der er under 70 år og ved godt helbred, er højdosis kemoterapi efterfulgt af stamcelletransplantation. Her er risikoen for, at der opstår sekundær kræft 10 år efter behandlingen helt oppe på 15 procent. En lille del af disse tilfælde vil være akut leukæmi, hvilket patienterne selvfølgelig advares mod forud for behandlingen, mens den mest typiske sekundære kræft er hudkræft.
Ved Revlimid, som både bruges til at slå sygdommen ned og til vedligeholdelse efter anden behandling er risikoen to-fem procent for at udvikle en sekundær kræft.
Det kan lyde skræmmende, men det er vigtigt at vide, at disse sekundære kræfttyper ofte kan behandles med godt resultat. Endnu vigtigere er det, at risikoen for at blive ramt af sekundær kræft, fx 15 år efter højdosis kemoterapi med stamcelletransplantation, kun findes fordi man overhovedet er i live takket være behandlingen.
Sekundær kræft og maligne T-celler ved CAR-T behandling
Lige nu ser det ud til at sekundær kræft efter behandling med CAR-T-celler kun rammer en meget lille andel af de behandlede patienter. Tallet er på nuværende tidspunkt 38 tilfælde ud af 42.000 overvågede patienter, der har fået CAR-T-cellebehandling.
Problemet ser derfor ud til at være meget mindre end ved de nuværende standardbehandlinger. Men det er ikke desto mindre noget der skal orienteres om og det skal overvåges.
Konklusionen fra både eksperterne på området fra EMA og FDA, er da også, at risikoen er minimal i forhold til fordelene ved behandlingen, og at fundene ikke giver anledning til ændringer i anbefalingerne med CAR-T-celler. Både i EU og i USA overvåges alle patienter nu efter CAR-T behandling. Det giver både større viden og grundlag for forskningen, og dertil giver det patienterne tryghed.